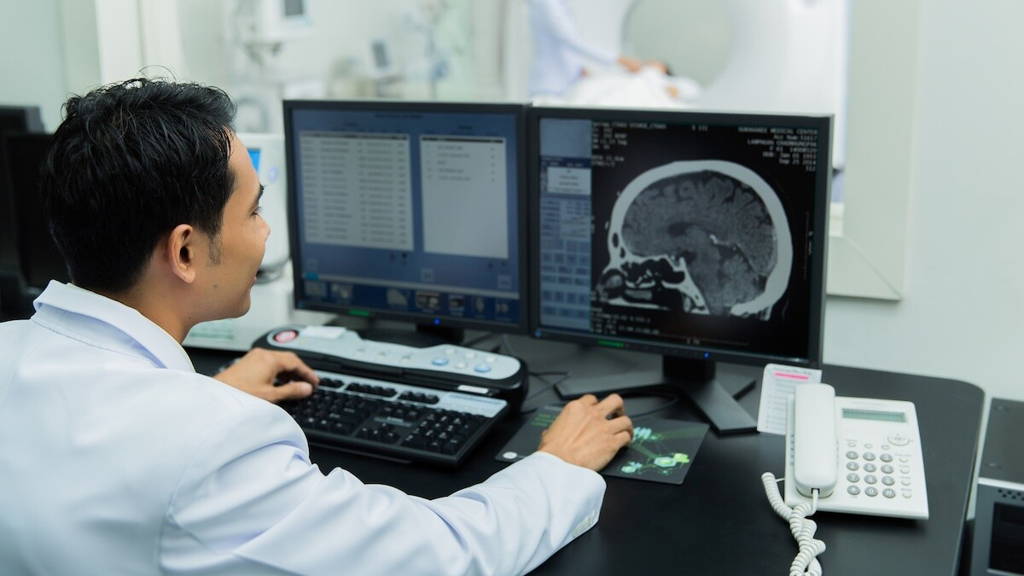
In de zoektocht naar snellere, minder invasieve en toch uiterst betrouwbare methoden voor tumordiagnostiek hebben onderzoekers van Charité, de universiteitskliniek van Berlijn, een nieuw en innovatief AI-model ontwikkeld. Het model, crossNN genaamd, is in staat om op basis van epigenetische kenmerken meer dan 170 verschillende soorten kanker nauwkeurig te detecteren. Het algoritme biedt een veelbelovende nieuwe route voor oncologische diagnostiek – niet alleen bij hersentumoren, maar ook bij andere vormen van kanker.
De technologie maakt gebruik van zogenaamde epigenetische vingerafdrukken: unieke patronen van chemische veranderingen in het DNA die kenmerkend zijn voor tumoren. Deze modificaties – zeg maar, aan- en uitknoppen voor genexpressie – worden niet direct bepaald door de genetische code zelf, maar wel door hoe die code wordt gelezen en gebruikt. Daarmee biedt het epigenoom waardevolle informatie over de aard en oorsprong van een tumor. Het onderzoek is onlangs gepubliceerd in Nature Cancer.
Hersenvocht gebruiken voor diagnose
Een van de grote voordelen van deze aanpak is dat materiaal voor analyse niet per se afkomstig hoeft te zijn uit een klassiek weefselbiopt. In het geval van hersentumoren is in veel gevallen een kleine hoeveelheid hersenvocht voldoende. Deze vloeistof is relatief eenvoudig en veilig te verkrijgen via een ruggenprik. Hierdoor kunnen diagnoses gesteld worden in situaties waarin een operatie of conventionele biopsie te riskant of zelfs onmogelijk is.
Een recent voorbeeld toont de kracht van deze aanpak: bij een patiënt die in last had van dubbelzien, wees een MRI op een hersentumor op een moeilijk bereikbare locatie. In plaats van een risicovolle hersenbiopsie toe te passen, werd hersenvocht afgenomen en geanalyseerd met behulp van crossNN. Binnen korte tijd kon een diagnose worden gesteld van een centraal zenuwstelsel-lymfoom, waarna onmiddellijk met gerichte chemotherapie gestart werd.
AI en epigenetica: nauwkeurig en uitlegbaar
Het crossNN-model is gebaseerd op een relatief eenvoudig neuraal netwerk, waarmee het zich onderscheidt van veel bestaande AI-oplossingen. Waar eerdere modellen vaak als ‘black box’ worden gezien – moeilijk uitlegbaar en dus lastig te vertrouwen – biedt crossNN volledige traceerbaarheid van hoe het tot een diagnose komt. En dat zonder in te leveren op nauwkeurigheid.
In tests met meer dan 5.000 tumormonsters wist het AI-model hersentumoren in bijna alle gevallen (99,1%) correct te classificeren. Nog indrukwekkender is dat het ook onderscheid weet te maken tussen meer dan 170 verschillende tumortypen afkomstig uit verschillende organen, met een nauwkeurigheid van 97,8 procent. Daarmee overtreft het de prestaties van bestaande diagnostische systemen.
“Het feit dat we dit niveau van precisie kunnen bereiken, zelfs met variabele gegevensbronnen en zonder volledig DNA-profiel, maakt deze technologie bijzonder robuust en breed toepasbaar,” aldus dr. Philipp Euskirchen, hoofdonderzoeker en verbonden aan het Duitse Kanker Consortium (DKTK) en het Instituut voor Neuropathologie van Charité.
AI en kankerdiagnostiek
De afgelopen periode schreven wij al vaker over ontwikkelingen waarbij AI ingezet wordt om de kankerdiagnostiek te verbeteren. Zo toonde een studie van UCLA Health Jonsson Comprehensive Cancer Center aan dat AI de detectie van intervalborstkanker kan versnellen. Intervalborstkanker ontwikkelt zich tussen twee reguliere screenings en wordt vaak gemist door radiologen vanwege subtiele tekenen.
In 2024 ontwikkelden onderzoekers van de Perelman School of Medicine aan de Universiteit van Pennsylvania de AI-tool iStar, die subtiele tekenen van kanker in weefsels kan herkennen. Deze tekenen zijn vaak niet zichtbaar met het blote oog. iStar analyseert genexpressie – de activiteit van genen in cellen – door middel van geavanceerde beeldvormingstechnieken.
Route naar de praktijk
De in Berlijn ontwikkelde technologie staat inmiddels op de drempel van bredere klinische toepassing. Samen met het DKTK wordt gewerkt aan grootschalige klinische proeven op acht locaties in Duitsland. Het doel is om de nauwkeurige, goedkope en patiëntvriendelijke diagnostiek op basis van DNA-analyse beschikbaar te maken voor de reguliere zorg. Daarnaast wordt gekeken naar intraoperatief gebruik, waarbij tumortypen direct tijdens een operatie kunnen worden vastgesteld.
Ook de snelheid van analyse is indrukwekkend. Dankzij nanopore sequencing – een nieuwe vorm van genetische analyse die real-time uitlezing van DNA mogelijk maakt – kan binnen enkele uren een volledige epigenetische vingerafdruk worden gegenereerd. Deze snelheid is van groot belang in spoedeisende situaties, zoals bij snelgroeiende tumoren of bij het plannen van een acute ingreep.
Gepersonaliseerde oncologie
De opkomst van AI-gedreven epigenetische diagnostiek past binnen de bredere trend van gepersonaliseerde oncologische zorg. In plaats van one-size-fits-all benaderingen, maakt deze technologie het mogelijk om snel en nauwkeurig te bepalen welk tumortype een patiënt heeft – en daarop de behandeling af te stemmen. Vooral bij zeldzame tumoren of onduidelijke ziektebeelden is dit een gamechanger.
“Diagnostiek moet niet alleen accuraat zijn, maar ook beschikbaar en uitvoerbaar in de praktijk,” stelt prof. Martin E. Kreis, Chief Medical Officer bij Charité. “Met modellen als crossNN zetten we een stap richting toegankelijke, efficiënte en gepersonaliseerde kankergeneeskunde.”